平成25年9 月 20日付け発行のネイチャー・コミュニケーションズ( Nature Communications)オンライン版で、疾患プロテオゲノム研究センター片桐豊雅教授・吉丸哲郎助教の研究グループの研究成果が発表されました。
乳がんの約70%は女性ホルモンであるエストロゲン依存性であり、その受容体(エストロゲン受容体:ER)の活性化を通じて細胞増殖を促進します。その治療法としては、主に抗エストロゲン剤であるタモキシフェンをはじめとする内分泌療法が術後補助療法や進行・再発乳癌の標準治療法として行われており、顕著な生存維持に貢献してきました。しかしながら、タモキシフェンの長期服用による耐性獲得、副作用の出現や不応例が存在し、深刻な問題となっており、耐性機構の解明および新規治療法の開発は喫緊の課題でありました。
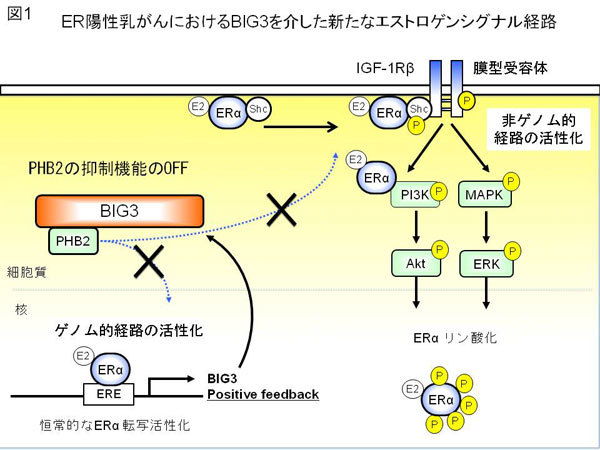
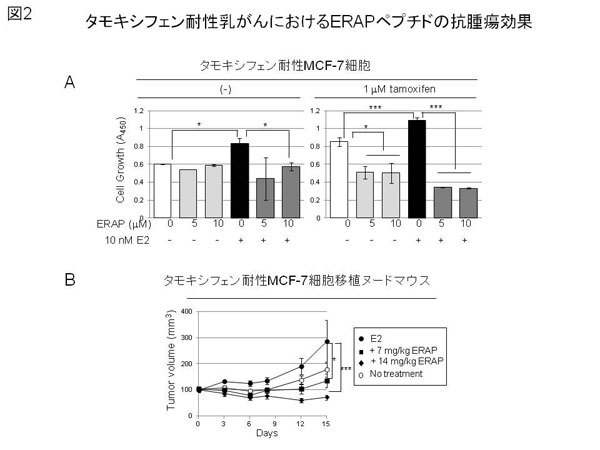
疾患プロテオゲノム研究センターゲノム制御分野の片桐豊雅教授・吉丸哲郎助教の研究グループは、これまでに網羅的遺伝子発現解析を通じて、乳がんに特異的に発現亢進を認める新規ER活性化制御分子BIG3 (Brefeldin A-Inhibited Guanine nucleotide-exchange protein 3)を同定していました。今回、エストロゲン依存性乳がん細胞の増殖には、BIG3によるERシグナル抑制因子PHB2の抑制機能制御が必須であることを見いだし、新たな乳がんにおけるBIG3を介したエストロゲンシグナル経路を提唱しました(図1)。さらに、BIG3-PHB2の相互作用を阻害するBIG3-PHB2ドミナント・ネガティブペプチド(ERAPペプチド)を見いだし、これをER陽性乳がん細胞へ投与することでBIG3から解放されたPHB2のER活性抑制機能を回復させ、ER陽性乳癌細胞およびヌードマウスに移植した乳がん細胞において顕著な抗腫瘍効果を引き起こすことに成功しました。また、タモキシフェン耐性を獲得した乳がんに対しても顕著な抗腫瘍効果を示すことがわかりました(図2)。ERAPペプチドを基にしたBIG3-PHB2の相互作用阻害する治療薬が開発されれば、タモキシフェンによる治療に効果のない患者や、治療後に再発した患者にも有用となります。
BIG3は乳がん細胞にのみ存在し、正常細胞には存在しないことから、抗がん剤において認められる重い副作用が起きないと考えられ、またERAPペプチドの効果はエストロゲンの量や作用には影響しないため、従来の抗ホルモン剤がエストロゲンの働きを抑えるために起きる更年期症状といった副作用が起きないことも期待されます。
(用語の解説)
ペプチド:アミノ酸が2個以上ペプチド結合(アミド結合)にて繋がった化合物の総称。
BIG3-PHB2ドミナント・ネガティブペプチド(優性阻害ペプチド):PHB2タンパク質と結合可能なアミノ酸配列を有するペプチドをいう。がん細胞内では、通常PHB2タンパク質はBIG3タンパク質と結合するが、このペプチドを投与することで細胞内のPHB2はBIG3タンパク質とペプチドとの競合的な結合が生じ、その結果PHB2とBIG3の結合阻害が起きる。