平成25年8月19日付けの米国科学アカデミー紀要(PNAS)電子版で、徳島大学疾患酵素学研究センターの真板宣夫准教授と、明治薬科大学櫻庭均教授らのグループの研究成果が発表されました。
細胞の中の老廃物は、リソソームと呼ばれる小器官で分解されます。リソソームの中で働く分解酵素のひとつ、α-L-イズロニダーゼは、皮膚に多く含まれるデルマタン硫酸を分解する機能を持ちます。そのため、この酵素がうまく働かなくなるとデルマタン硫酸が分解されず過剰に蓄積され、1型ムコ多糖症という病気を引き起こします。真板宣夫准教授らは、1型ムコ多糖症の発症メカニズムおよび治療薬の開発を目的にα-L-イズロニダーゼの結晶構造解析を行いました。
すると驚いたことに、α-L-イズロニダーゼの372番目のアスパラギンに付加している糖鎖が、基質であるデルマタン硫酸と直接相互作用することが解りました。さらに糖鎖の影響を調べたところ、デルマタン硫酸を分解する反応にも糖鎖が関わっていることが解りました。このように、糖鎖が基質と直接相互作用する例は今まで知られていませんでした。α-L-イズロニダーゼの構造を基に1型ムコ多糖症の患者で見つかった変異を解析したところ、372番目のアスパラギンに結合している糖鎖の構造が不安定になるような突然変異が見つかりました。このような変異を持つ患者に対しては、この糖鎖の構造を安定化させるような化合物(ケミカルシャペロン)は、治療薬としての効果が期待されます。
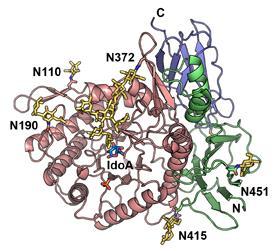
図:α-L-イズロニダーゼのリボンモデル。結合している糖鎖は黄色で、
基質であるL-イズロン酸(IdoA)は青色で表す。N110, N190, N372, N415,
N451は糖鎖が付加されたアスパラギンを表す。
書誌情報
DOI: 10.1073/pnas.1306939110
タイトル: Human α-L-iduronidase uses its own N-glycan as a substrate-binding and catalytic module
著者: Nobuo Maita, Takahiro Tsukimura, Takako Taniguchi, Seiji Saito, Kazuki Ohno, Hisaaki Taniguchi & Hitoshi Sakuraba
雑誌: Proceedings of the National Academy of Sciences USA






