令和4年度 若手研究者学長表彰 研究成果報告
報告者
徳島大学病院消化器・移植外科 講師 高須千絵
徳島大学消化器・移植外科研究グループ
- The BAFF/NFκB axis is crucial to interactions between sorafenib-resistant HCC cells and cancer-associated fibroblasts.
Gao L, Morine Y, Yamada S, Saito Y, Ikemoto T, Tokuda K, Miyazaki K, Okikawa S, Takasu C, Shimada M.
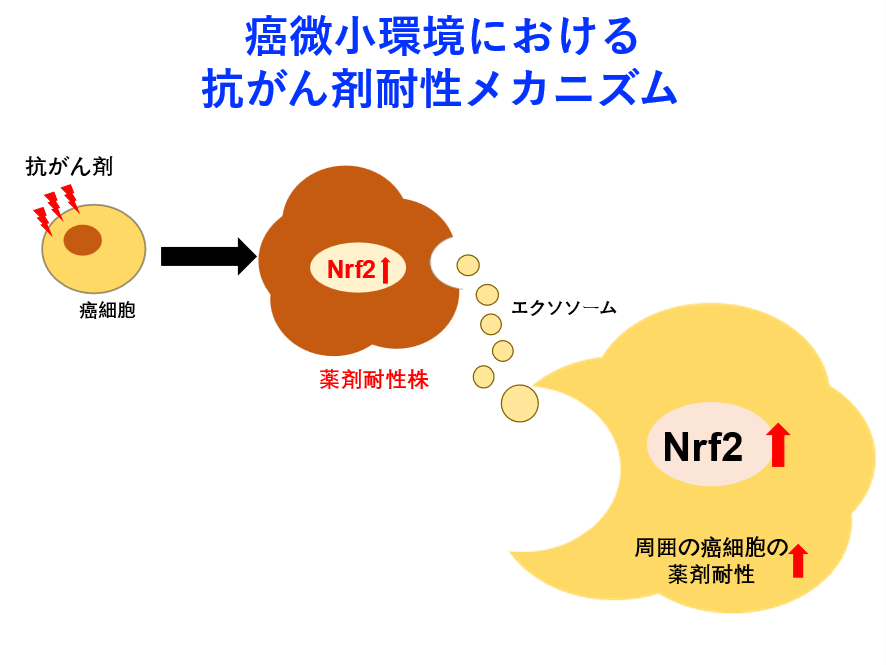
Cancer Sci. 2021 Sep;112(9):3545-3554. doi: 10.1111/cas.15041. Epub 2021 Jul 16. - Nrf2 signaling promotes cancer stemness, migration, and expression of ABC transporter genes in sorafenib-resistant hepatocellular carcinoma cells.Gao L, Morine Y, Yamada S, Saito Y, Ikemoto T, Tokuda K, Takasu C, Miyazaki K, Shimada M.PLoS One. 2021 Sep 2;16(9):e0256755. doi: 10.1371/journal.pone.0256755. eCollection 2021.
- The interaction between cancer associated fibroblasts and tumor associated macrophages via the osteopontin pathway in the tumor microenvironment of hepatocellular carcinoma.
Tokuda K, Morine Y, Miyazaki K, Yamada S, Saito Y, Nishi M, Tokunaga T, Ikemoto
T, Imura S, Shimada M.
Oncotarget. 2021 Feb 16;12(4):333-343. doi: 10.18632/oncotarget.27881. eCollection
2021 Feb 16. - Cancer‑associated fibroblast‑induced M2‑polarized macrophages promote hepatocellular carcinoma progression via the plasminogen activator inhibitor‑1 pathway.
Chen S, Morine Y, Tokuda K, Yamada S, Saito Y, Nishi M, Ikemoto T, Shimada M.
Int J Oncol. 2021 Aug;59(2):59. doi: 10.3892/ijo.2021.5239. Epub 2021 Jul 1. - Inhibition of the VEGF signaling pathway attenuates tumor‑associated macrophage activity in liver cancer.
Okikawa S, Morine Y, Saito Y, Yamada S, Tokuda K, Teraoku H, Miyazaki K, Yamashita S, Ikemoto T, Imura S, Shimada M.
Oncol Rep. 2022 Apr;47(4):71. doi: 10.3892/or.2022.8282. Epub 2022 Feb 16.
研究概要
腫瘍組織は癌細胞だけでなく、線維芽細胞、免疫担当細胞(マクロファージ・Tリンパ球など)、脈管構成細胞が集蔟し、それぞれ相互活性・分化誘導制御する腫瘍微小環境(tumor microenvironment: TME)を形成しています。これまで癌細胞の腫瘍悪性度増強・薬剤耐性メカニズムの研究や、腫瘍微小環境に対する血管新生阻害剤や免疫チェックポイント阻害剤が開発され、実臨床において一定の効果を発揮していますが、難治性癌に向けた腫瘍微小環境のダイナミックな環境変化(癌構成細胞機能変化)には対応できていないのが現状です。
本研究で着目した癌関連線維芽細胞(Cancer associated fibroblast: CAF)と癌関連マクロファージ(Tumor-associated macrophage: TAM)は、癌細胞を含めた相互作用を有し、TME構築の早期からCancer cell-CAF-TAM interactionを形成します。さらに後期にはそのinteractionから免疫抑制・血管増生が誘導され、難治性腫瘍微小環境を完成させることから、腫瘍微小環境の克服には、微小環境構築の根幹であり早期に形成されるCancer cell-CAF-TAM interactionの攻略が必要で、このinteractionにおけるクロストークを詳細に解明することが薬剤耐性獲得機序解明や難治性癌治療のブレークスルーとなると考え、研究を行っています。
今後の展望(研究者からのコメント)
肝細胞癌が予後不良である原因の1つが、薬剤抵抗性の獲得です。今回の研究成果が、薬剤耐性獲得の機序解明に繋がり、肝細胞癌に対する革新的な治療戦略になるよう、これらも研究を進めて参ります。






