令和2年12月15日
徳島大学大学院医歯薬学研究部薬理学分野 池田康将教授、徳島大学病院薬剤部 濱野裕章薬剤師らの研究グループは、抗がん薬シスプラチン誘発性腎障害を予防可能な既存薬物を同定しました。
この研究成果は2020年12月9日 (日本時間2020年12月10日)付で国際腎臓学会の公式学術誌「Kidney International」に掲載されました。
【発表論文の情報】
掲載誌名:Kidney International
論文題目:Diphenhydramine may be a preventive medicine against cisplatin-induced kidney toxicity
論文著者:Hirofumi Hamano, Yasumasa Ikeda, Mitsuhiro Goda, Keijo Fukushima, Seiji Kishi, Masayuki Chuma, Michiko Yamashita, Takahiro Niimura, Kenshi Takechi, Masaki Imanishi, Yoshito Zamami, Yuya Horinouchi, Izawa-Ishizawa Yuki, Licht Miyamoto, Ishizawa Keisuke, Hiromichi Fujino, Toshiaki Tamaki, Ken-ichi Aihara and Koichiro Tsuchiya
【発表のポイント】
・米国医薬品有害事象データベースの解析から、シスプラチン腎障害を抑制する可能性のある候補薬として抗ヒスタミン薬ジフェンヒドラミンを抽出した。
・シスプラチン腎障害対するジフェンヒドラミンの効果について、従来の培養細胞・動物モデルを用いた基礎研究手法により、その抑制効果ならびに機序について明らかにした。
・徳島大学病院のカルテ調査を用いた後ろ向き臨床研究からも、ジフェンヒドラミンのシスプラチン誘発性急性腎障害の抑制効果が認められた。
【概要】
古典的抗がん薬であるシスプラチンは、現在でも種々のがん治療薬として頻用されていますが、腎障害の副作用があります。しかしながら、臨床的に実用化された予防薬はありません。今回、大規模医療データベースを用いたシスプラチン腎障害症例における併用薬の解析から、シスプラチン腎障害予防薬の候補として5つを抽出し、そのうち抗アレルギー薬であるジフェンヒドラミン(Diphenhydramine; DPH)に着目しました。尿細管培養細胞とマウスモデルの検討では、シスプラチンによる腎機能悪化、炎症性サイトカイン上昇、酸化ストレス・アポトーシスの増加は、DPHにより抑制されました。DPHの腎障害抑制作用はヒスタミン受容体抑制に加えて、腎臓へのシスプラチン取り込み抑制効果であることを見出しました。また、DPHは、抗腫瘍効果に対して影響せずに、腎障害を抑制しました。この結果をもとに、徳島大学病院の初回シスプラチン投与患者約1500名を調べると、シスプラチン投与前にDPHを投薬した患者において、シスプラチン投与による急性腎障害が抑制されていました。DPHは、古くから使用されている抗ヒスタミン薬であり、がん治療においても併用されているため、新たなプロトコールを構築する必要もなく、速やかに腎障害予防の支持療法を確立できると考えられ、がんサバイバーの生活の質と生命予後の改善につながることが期待されます。
【詳細な説明】
がん治療成績の向上によるがんサバイバーの増加に伴って、がん治療関連臓器合併症が新たな問題となっています。がん治療関連臓器合併症の一つに腎障害があり、抗がん薬誘発性急性腎障害(AKI)は、一旦改善してもその既往が慢性腎臓病(CKD)の原因となることが知られています。CKDを発症すると、その後の抗がん治療に影響するのみならず、CKDそのものが様々な疾患の危険因子であり、進行すると最終的に血液透析治療が必要となります。よって、CKDを予防するにはAKI抑制が鍵です。古典的抗がん薬であるシスプラチンは、現在でも種々のがん治療薬として用いられていますが、副作用として腎障害を引き起こしやすい抗がん薬として知られています。そのため、シスプラチン誘発性腎障害に対しては、これまでにも多くの研究がなされており、発症機序、予防法が報告されているものの臨床的に実用化されたものはないのが現状です。本研究では、がん治療関連腎障害の原因抗がん薬として、最も多いシスプラチン腎障害に対して予防効果がある既存薬を同定することを目的としました。
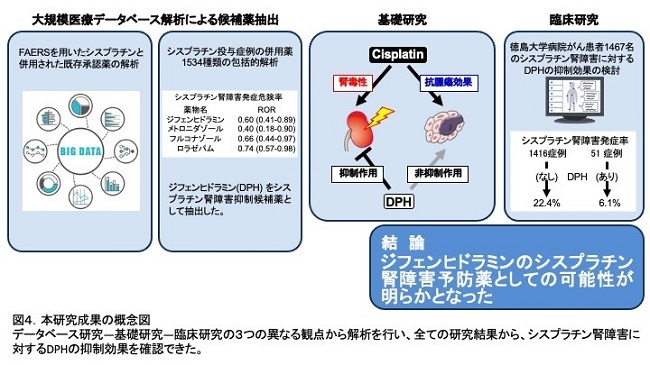
まず、米国食品医薬品局の有害事象自発報告データベーであるFDA Adverse Event Reporting System(FAERS)を用いたシスプラチン腎障害症例における併用薬の解析を行いました。FAERSは薬物安全性評価のデータベースであり、算出するReporting Odds Ratio (ROR) が基準値を超える(ROR>1.0)有害事象は、安全性に問題がある副作用シグナルとして検出される一方で、シグナル値が低下するもの(ROR<1.0;逆シグナル)はその医薬品の使用によって副作用の予防効果を示す可能性があり、既存医薬品の未知の有効性を示す可能性があります。シスプラチン腎障害症例に併用された1534種類の薬から、ROR<1.0の4つを抽出しました。その中から、抗アレルギー薬ジフェンヒドラミン(Diphenhydramine; DPH)(ROR 0.60 (0.41-0.88))を候補薬として以後の検討に用いました。
2種類の尿細管培養細胞を用いた検討により、DPHはシスプラチンによる細胞死を抑制することを確認できたことから、引き続いて、シスプラチン腎障害マウスモデルを用いた検討を行いました。シスプラチン投与によって引きおこされる腎障害(腎機能悪化、病理組織変化、炎症性サイトカイン上昇、酸化ストレス・アポトーシス増加)はDPHによって抑制されました(図1A)。ヒスタミン受容体を欠損したマウス(H1RKO)でも、シスプラチン腎障害は抑制されましたが、その効果はDPH投与マウスよりも弱いものであったことから、H1RKOマウスへDPHを投与すると、さらなるシスプラチン腎障害抑制効果を示しました(図1B)。よって、DPHのシスプラチン腎障害抑制効果はヒスタミン受容体抑制に加えて、別の作用を介することが考えられました。
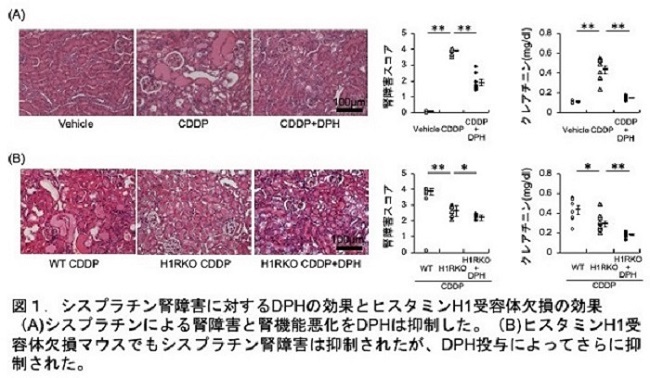
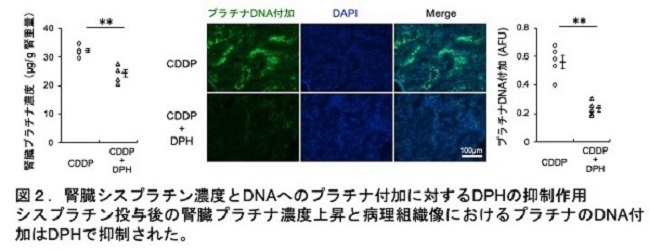
シスプラチンは、主に腎臓近位尿細管に存在するorganic cation transporter 2 (OCT2)を介して取り込まれ尿細管に蓄積することで腎障害を引き起こします。KEGG(Kyoto Encyclopedia of Genes and Genomes:バイオインフォマティクス研究用データベース)の解析により、DPHがorganic cation transporter 2 (OCT2)の阻害作用を有していることが分かりました。腎臓のシスプラチン濃度測定とシスプラチン(プラチナ)DNA付加を調べると、DPH投与によって腎臓へのシスプラチン蓄積が抑制されることがわかりました。従って、DPHのシスプラチン取込み抑制を介した腎障害の軽減効果が明らかになりました(図2)。
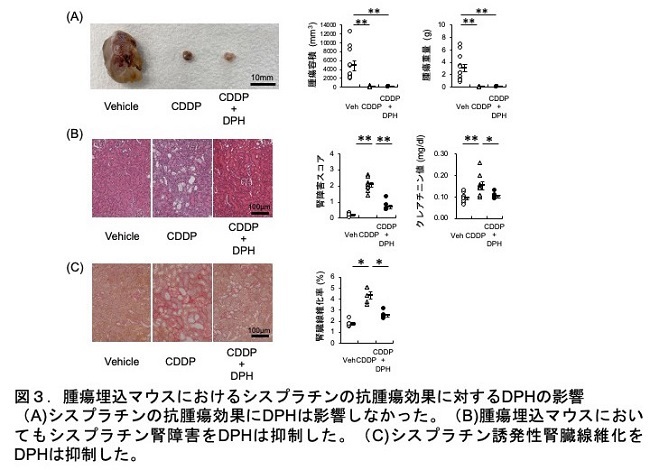
シスプラチンの抗腫瘍効果に対するDPH作用について、各種培養がん細胞を用いた検討では、シスプラチンの抗腫瘍効果に対してDPHは影響せず、がん種によってはシスプラチンの抗腫瘍効果をむしろ増強していました。また、がん埋め込みマウスの検討でも、DPHはシスプラチンの抗腫瘍効果に対して影響せずに、腎障害を抑制できることが確認できました(図3)。
実臨床ではどうかを検討するため、徳島大学病院の初回シスプラチン投与患者1467名におけるAKI発症について、カルテベースの後ろ向き解析を行いました。そのうちDPH投与患者は51名、非投与患者は1416名でした。しかし、両群の患者背景が異なるため、傾向スコア法を用いて患者背景を一致するよう修正したあとに解析しました。DPH投与群、非投与群49名で解析したところシスプラチン投与後AKI発症率は、DPH投与群で有意に低値でした(6.1% vs 22.4%, p=0.04)。
がんサバイバーは、がんを克服できても、がん治療関連臓器合併症による予後の悪化という新たな問題に直面しています。そのため、がん治療においては、制がんという従来の目的を達成すること同時に、治療中から臓器合併症の予防・治療について考慮することが重要です。本研究は、がん治療関連腎障害で多くみられるシスプラチン誘発性腎障害予防できる既存承認薬としてDPHを同定しました。本研究では、データベース研究―基礎研究―臨床研究の3つの異なる観点から解析を行い、全てにおいてシスプラチン腎障害に対するDPHの抑制効果を確認できたことより、信頼性がより高い知見と考えられます(図4)。
既存承認薬から新たな薬効を発見するドラッグリポジショニングは、従来の新薬開発とは異なり、開発コストの低減や早期の臨床応用に有利です。本研究で同定されたDPHは、がん治療における併用薬から見いだされたことより、新たながん治療プロトコールを構築することなく、がん薬物療法関連腎障害予防の支持療法の確立につながります。最初に述べたように、抗がん薬誘発性AKIを予防することで、その後の抗がん薬投与用量制限によるがん治療への影響や、がん治療後のCKDへの移行・進展を阻止でき、CKDとその合併症の治療を含めた医療費の抑制につながると考えられます。また本研究成果を基にした前向き臨床試験を行うことで、その効果を確認して臨床応用されることで、今後さらなる増加が予想されるがんサバイバーの生活の質と生命予後の改善に寄与することが期待されます。
【謝辞】
本研究は、平成30年度 徳島大学・大鵬薬品工業株式会社 がん関連基礎研究助成、日本学術振興会科学研究費 基盤研究 C(18K08480)、若手研究(20K17285)の支援を受けて行われました。






