平成30年度 若手研究者学長表彰 研究成果報告
徳島大学大学院医歯薬学研究部消化器・移植外科学 特任助教 柏原 秀也
肥満手術における術後早期の血糖上昇抑制効果に関するメカニズムについての研究
【研究グループ】
- 徳島大学大学院医歯薬学研究部消化器・移植外科学 教授 島田 光生
- 徳島大学病院消化器・移植外科 講師 吉川 幸造
- 徳島大学病院消化器・移植外科 助教 東島 潤
- 徳島大学病院消化器・移植外科 助教 徳永 卓哉
- 徳島大学病院周産母子センター 助教 西 正暁
- 徳島大学大学院医歯薬学研究部消化器・移植外科学 講師 高須 千絵
【学術誌等への掲載状況】
1.Kashihara H, Shimada M, Yoshikawa K, Higashijima J, Miyatani T, Tokunaga T, Nishi M, Takasu C.
The Effect of Roux-en-Y Reconstruction on Type 2 Diabetes in the Early ostoperative Period.
Anticancer Res. 2018 Aug;38(8):4901-4905.
2.Kashihara H, Shimada M, Yoshikawa K, Higashijima J, Tokunaga T, Nishi M, Takasu C, Ishikawa D.
Correlation Between Thrombospondin-1 Expression in Non-cancer Tissue and Gastric Carcinogenesis.
Anticancer Res. 2017 Jul;37(7):3547-3552.
3.Kashihara H, Shimada M, Yoshikawa K, Higashijima J, Tokunaga T, Nishi M, Takasu C.
Risk factors for recurrence of gastric cancer after curative laparoscopic gastrectomy.
J Med Invest. 2017;64(1.2):79-84. doi: 10.2152/jmi.64.79.
4.Kashihara H, Shimada M, Yoshikawa K, Higashijima J, Nakao T, Nishi M, Takasu C.
Duodenal-jejunal bypass changes the composition of the gut microbiota.
Surg Today. 2017 Jan;47(1):137-140. Epub 2016 Jul 13.
5.Kashihara H, Shimada M, Kurita N, Iwata T, Sato H, Yoshikawa K, Miyatani T, Takasu C, Matsumoto N, Ishibashi H.
Duodenal-Jejunal Bypass Improves Insulin Resistance by Enhanced Glucagon-Like Peptide-1 Secretion Through Increase of Bile Acids.
Hepatogastroenterology. 2014 Jun;61(132):1049-54.
6.Kashihara H, Shimada M, Kurita N, Iwata T, Sato H, Kozo Yoshikawa, Higashijima J, Chikakiyo M, Nishi M, Matsumoto N.
CD133 expression is correlated with poor prognosis in colorectal cancer.
Hepatogastroenterology. 2014 Sep;61(134):1563-7.
7.Kashihara H, Shimada M, Kurita N, Iwata T, Sato H, Yoshikawa K, Miyatani T, Takasu C, Matsumoto N.
Protein kinase Cι is a new prognostic factor in gastric cancer.
Surg Today. 2015 Jun;45(6):759-64. doi: 10.1007/s00595-014-1010-5. Epub 2014 Aug 10.
8.Kashihara H, Shimada M, Kurita N, Sato H, Yoshikawa K, Higashijima J, Chikakiyo M, Nishi M, Takasu C.
Duodenal-jejunal bypass improves diabetes and liver steatosis via enhanced glucagon-like peptide-1 elicited by bile acids.
J Gastroenterol Hepatol. 2015 Feb;30(2):308-15. doi: 10.1111/jgh.12690.
9.Kashihara H, Shimada M, Kurita N, Iwata T, Nishioka M, Morimoto S, Yoshikawa K, Miyatani T, Mikami C.
Comparisons of inflammatory cytokines expressions in drain after laparoscopic versus open surgery.
Hepatogastroenterology. 2014 Mar-Apr;61(130):379-81.
肥満は全世界的に増加しており、我が国においてもBMI35以上の病的肥満患者が増加しています。そのような患者に対してはこれまで内科的治療が行われていましたが、不成功に終わることが多く、近年では病的肥満に対する減量手術が国内外で積極的に行われており、良好な成績が報告されています。
減量手術は、胃を小さくする胃縮小術とバイパスなどの消化管流路変更を加え消化吸収を抑制する消化吸収抑制術に大別されます。特に消化吸収抑制術には肥満の改善だけでなく、2型糖尿病や非アルコール性脂肪肝炎 (NASH)などの肥満関連疾患に対する効果も報告されています。このメカニズムとしては、回腸より分泌されるインスリン分泌促進作用をもつグルカゴン様ペプチド-1 (Glucagon like peptide-1: GLP-1)の関与が報告されてますが、その詳細なメカニズムについては未だ不明です。
これまでに我々は、ラット減量手術モデルであるDuodenal-jejunal bypass (DJB) (図1)を用いて「肥満症」に対する外科治療は、回腸での胆汁酸吸収増加によりGLP-1分泌細胞であるL細胞の増加を来し、GLP-1分泌を増加させ、2型糖尿病やNASHを改善することを報告しました。さらにNASH抑制効果については、GLP-1アナログ製剤であるLiraglutideを投与した内科的治療を凌駕していました (JGH 2015)。また、DJBの腸内細菌叢Gut microbiotaは他の群と比較し、顕著に変化しており、この変化が一連の効果に関わっていることが示唆されました (Surgery today 2017) (図2)。
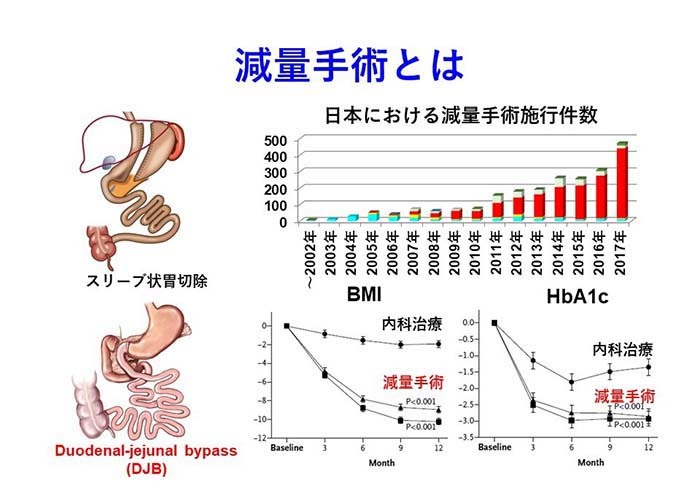
図1
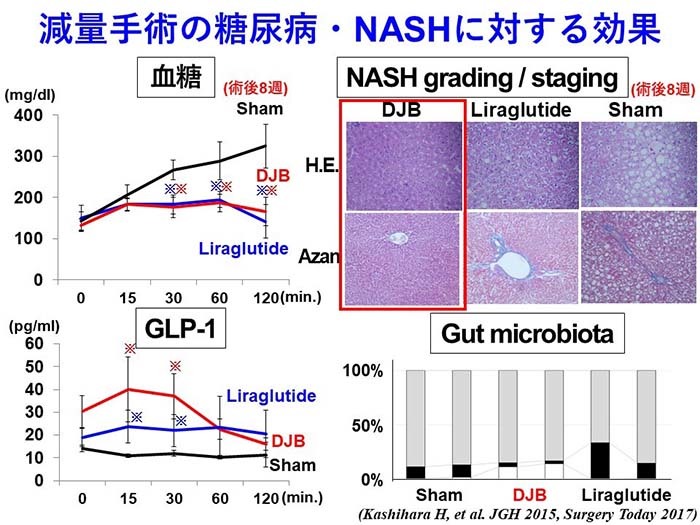
図2
近年、日本でも病的肥満症に対する減量手術、腹腔鏡下スリーブ状胃切除術 (LSG)が保険適応となり、その効果が多数報告されています。この症例数の増加に伴い、内科的に治療抵抗性であった2型糖尿病患者にLSGを施行すると、これまで大量のインスリン投与が必要であった方が術後早期 (術後2日目以内)よりインスリンが不要となる症例がしばしばみられました。しかし、これまでの基礎・臨床での検討では術後4週目以降の報告のみであり、術後早期での血糖上昇抑制効果に関する検討は未だ報告がありません。
今後は減量手術における術後早期血糖上昇抑制効果に関するメカニズムについての検討を行っていきたいと考えています。






