平成30年度 若手研究者学長表彰 研究成果報告
徳島大学病院 血液内科 特任助教 原田 武志
多発性骨髄腫の進展と治療抵抗性獲得の分子機序の解明 および新規治療法の創出
【研究グループ】
- 徳島大学大学院医歯薬学研究部 血液・内分泌代謝内科学分野 教授 安倍 正博
- 徳島大学大学院医歯薬学研究部 血液・内分泌代謝内科学分野 教務補佐員 小田 明日香
- 徳島大学大学院医歯薬学研究部 組織再生制御学分野 講師 寺町 順平
- 徳島大学病院 矯正歯科 助教 日浅 雅博
- 徳島大学大学院医歯薬学研究部 口腔顎顔面矯正学分野 特任助教 天眞 寛文
【学術誌等への掲載状況】(2017年以降)
1. Bat-Erdene A, Nakamura S, Oda A, Iwasa M, Teramachi J, Ashtar M, Harada T, Miki H, Tenshin H, Hiasa M, Fujii S, Sogabe K, Oura M, Udaka K, Kagawa K, Yoshida S, Aihara K, Kurahashi K, Endo I, Abe M. Class 1 HDAC and HDAC6 inhibition inversely regulates CD38 induction in myeloma cells via interferon- and ATRA. Br J Haematol. 2018 in press
2. Fujii S, Nakamura S, Oda A, Miki H, Tenshin H, Teramachi J, Hiasa M, Maeda Y, Oura M, Takahashi M, Iwasa M, Endo I, Yoshida S, Aihara K, Kurahashi K, Harada T, Kagawa K, Nakao M, Sano S, Abe M. Unique anti-myeloma activity by thiazolidine-2,4-dione compounds with Pim inhibiting activity. Br J Haematol. 2018;180:246-258.
3. Gulla A, Hideshima T, Bianchi G, Fulciniti M, Kemal Samur M, Qi J, Tai YT, Harada T, Morelli E, Amodio N, Carrasco R, Tagliaferri P, Munshi NC, Tasspne P, Anderson KC. Protein arginine methyltransferase (PRMT5) has prognostic relevance and is a druggable target in multiple myeloma. Leukemia. 2018;32(4):996-1002.
4. Teramachi J, Hiasa M, Oda A, Harada T, Nakamura S, Amachi R, Tenshin H, Iwasa M, Fujii S, Kagawa K, Miki H, Kurahashi K, Yoshida S, Endo I, Haneji T, Matsumoto T, Abe M. Pim-2 is a critical target for treatment of osteoclastogenesis enhanced in myeloma. Br J Haematol. 2018;180(4):581-585.
5. Miki H, Nakamura S, Oda A, Tenshin H, Teramachi J, Hiasa M, Bat-Erdene A, Maeda Y, Oura M, Takahashi M, Iwasa M, Harada T, Fujii S, Kurahashi K, Yoshida S, Kagawa K, Endo I, Aihara K, Ikuo M, Itoh K, Hayashi K, Nakamura M, Abe M. Effective impairment of myeloma cells and their progenitors by hyperthermia.Oncotarget. 2017;9(12):10307-10316.
6. Tenshin H, Teramachi J, Oda A, Amachi R, Hiasa M, Bat-Erdene A, Watanabe K, Iwasa M, Harada T, Fujii S, Kagawa K, Sogabe K, Nakamura S, Miki H, Kurahashi K, Yoshida S, Aihara K, Endo I, Tanaka E, Matsumoto T, Abe M. TAK1 inhibition subverts the osteoclastogenic action of TRAIL while potentiating its antimyeloma effects. Blood Adv. 2017;1:2124-2137.
7. Harada T, Ohguchi H, Grondin Y, Kikuchi S, Sagawa M, Tai YT, Mazitschek R, Hideshima T, Anderson KC. HDAC3 regulates DNMT1 expression in multiple myeloma: therapeutic implications. Leukemia. 2017;31(12):2670-2677.
8. Ohguchi H, Harada T, Sagawa M, Kikuchi S, Tai YT, Richardson PG, Hideshima T, Anderson KC. KDM6B modulates MAPK pathway mediating multiple myeloma cell growth and survival. Leukemia. 2017;31(12):2670-2677.
9. Sagawa M, Ohguchi H, Harada T, Samur M, Tai YT, Munshi N, Kizaki M, Hideshima T, Anderson KC. Ribonucleotide reductase large subunit (RRM1) as a novel therapeutic target in multiple myeloma.Clin Cancer Res. 2017;31(1):258-262.
10. Harada T, Miki H, Cui Q, Oda A, Amachi R, Teramachi J, Bat-Erdene A, Sogabe K, Iwasa M, Fujii S, Nakamura S, Kagawa K, Yoshida S, Endo I, Aihara K, Ozaki S, Matsumoto T, Abe M. Expansion of Th1-like V9V2T cells by new generation IMiDs, lenalidomide and pomalidomide, in combination with zoledronic acid. Leukemia. 2017;31(1):258-262.
多発性骨髄腫は単クローン性形質細胞が骨髄内で増殖し、進行性の免疫不全や広範な骨破壊病変を特徴とする造血器悪性腫瘍です。新規治療薬の開発により、骨髄腫患者の生存期間は延長してきておりますが、依然として治癒がもたらされません。そのため、本症の進展機序の解明と治療抵抗性の克服は大きな臨床課題です。我々は、この課題を解決するために、多面的な研究を行い、治療標的の発見や新規治療法の開発に繋げる研究を進めています。
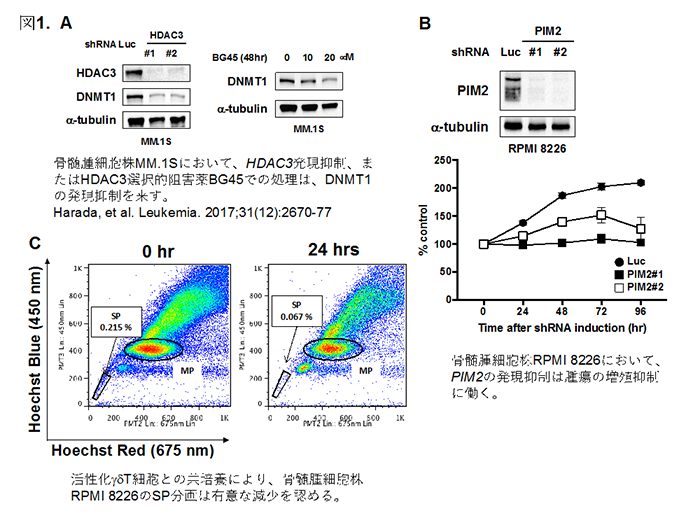
ヒストン脱アセチル化酵素(HDAC)は遺伝子発現やタンパク質の安定性などを調節しています。我々は、class 1 HDACのアイソフォームであるHDAC3は骨髄腫細胞で高発現し、DNAメチル化酵素DNMT1の発現を制御することで、骨髄腫細胞の生存増殖に重要な役割を果たしていることを報告しました(図1A)。さらに我々は、骨髄腫細胞の骨髄生育環境が賦与する治療抵抗性の原因因子を網羅的に探索し、多発性骨髄腫の新規治療標的として、PIM2キナーゼを見出しました(図1B)。上記のHDAC3を介する生存経路と同時にPIM2を阻害すると、骨髄腫細胞に対し協調的な細胞死が誘導されることが明らかとなり、新規治療戦略としてclass 1 HDAC阻害とPIM2阻害の併用療法を検討しております。
また、多発性骨髄腫に対する免疫療法として、新規抗体医薬の開発や、腫瘍前駆細胞も標的にしうるTh1様γδT細胞を用いた免疫療法の開発も進めています(図1C)。
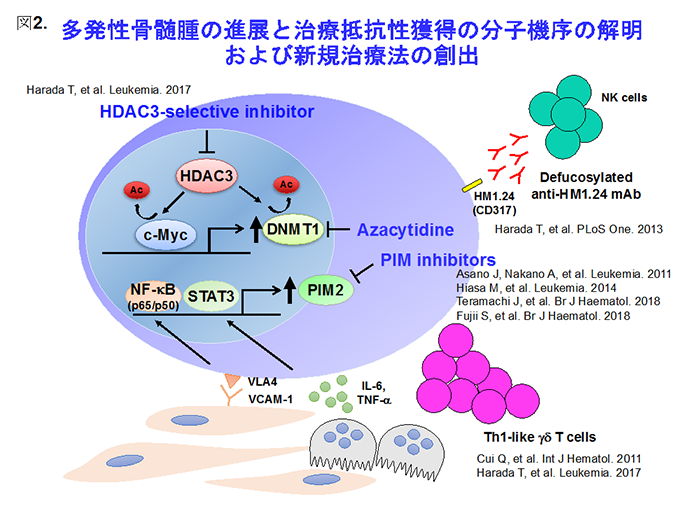

薬剤耐性というがん治療に立ちはだかる難敵を克服するために、骨髄腫細胞の骨髄生育環境が賦与する治療抵抗性の病態を多角的な視点から捉えながら、新規治療法の開発を進めたいと思います(図2)。現在取り組んでいる、骨髄腫細胞やその前駆細胞でのclass 1 HDACアイソフォームそれぞれの発現、活性の制御機構、そしてそれらの薬剤耐性をもたらす詳細な分子生物学的機序を解明するつもりです。さらに、本学薬学域で合成を進めて頂いている新規PIM阻害薬の臨床応用を目指した研究や、γδT細胞のより簡便で効率的な増幅法の開発とともに免疫調節薬などの新規抗骨髄腫薬を併用した、より抗腫瘍活性の高い免疫療法の開発などの研究を展開する予定です。
http://www.tokudai-ichinai.jp/ (血液・内分泌代謝内科学ホームページ)






