大学院医歯薬学研究部 人類遺伝学分野 准教授 増田清士
食道がんの進行に関わるマイクロRNA(miRNA)を制御する新しいがん促進分子KHSRPの同定とその分子機構の解明
【研究グループ】
- 徳島大学大学院医歯薬学研究部人類遺伝学分野:井本逸勢
【研究経緯】
食道がんはリンパ節転移を起こしやすく、周囲の臓器に浸潤しやすいため、消化器がんの中で極めて予後が悪いことが知られています。また使用できる抗がん剤の種類と効果は限られていることから、大腸がんや乳がんなどに用いられているような分子標的薬の開発が望まれています。マイクロRNA(miRNA)は、約22塩基の小さなRNAで、がんを含む様々な疾患でその機能異常が認められることから、新たな治療標的や診断マーカーの候補として注目されていますが、なぜがん細胞で特定のmiRNAに機能異常が起こるのか、その理由は明らかにされていませんでした。この度、徳島大学大学院医歯薬学研究部人類遺伝学分野の井本逸勢教授、増田清士准教授らの研究グループは、RNA結合蛋白質(RBP)ファミリーの1つであるKH-type splicing regulatory protein(KHSRP)が食道扁平上皮がんの進展に関わる特定のマイクロRNAの発現制御を介して悪性形質の獲得に深く関与することを発見しました。この研究結果は、KHSRPが食道がんにおけるmiRNAの機能異常のハブとして働くがん遺伝子であり、新たな悪性度の診断や治療標的となり得ることを明らかにするものです。
【学術誌等への掲載状況】
KH-type splicing regulatory protein is involved in esophageal squamous cell carcinoma progression. Fujita Y, Masuda K, Hamada J, Shoda K, Naruto T, Hamada S, Miyakami Y, Kohmoto T, Watanabe M, Takahashi R, Tange S, Saito M, Kudo Y, Fujiwara H, Ichikawa D, Tangoku A, Otsuji E, Imoto I. Oncotarget. 2017 Sep. 15
【研究の背景】
食道がん(食道扁平上皮がん)はリンパ節転移を起こしやすく、周囲の臓器に浸潤しやすいため、消化器がんの中で極めて予後が悪いことが知られています。最近では、早期診断、手術方法、抗がん剤治療の進歩により生存率が向上していますが、十分なものとは言えません。また、遠隔転移のある進行食道がんや手術後に再発したがんに対しては主に抗がん剤治療が行われますが、食道がんに使用できる抗がん剤の種類や効果は限られており、大腸がんや乳がんなどに用いられているような分子標的薬の開発が望まれています。
近年、ゲノムDNAから、タンパク質に翻訳されない多くのノンコーディングRNA(ncRNA)がつくられることがわかり、それらの機能が注目されています。ncRNAの中でも、マイクロRNA(miRNA)と呼ばれる短いRNAは、複数の遺伝子の働きを抑制することで細胞増殖・分化や細胞死などを調節しており、この機構の破綻ががんや神経変性疾患などの様々な病気の原因となることが知られています。特にがん細胞では、がんの発生や進行を制御する遺伝子の働きを調節する特定のmiRNAに発現異常が認められることから、診断マーカーとして有用なだけでなく、これを制御することで一度に多くの分子に影響を及ぼせる有望な治療標的と考えられていますが、その発現異常の分子機構などの詳細はよくわかっていませんでした。
【結果の概要】
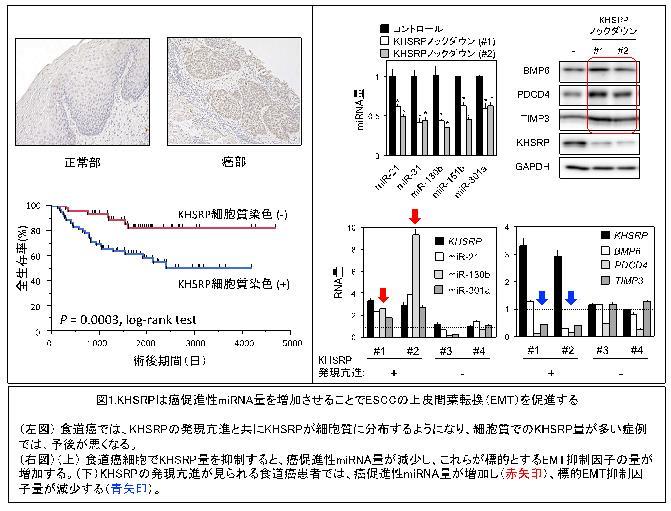
本研究グループは、食道がん手術組織を用いた解析から、これまでmiRNAの生合成に関与するとされていたKHSRP蛋白質が、食道がんの発生と進展に伴って高発現するだけでなく、核内から細胞質に移行することを見いだしました。また、細胞質でのKHSRP量が患者予後の悪化と明らかに関連することがわかりました(図1左)。KHSRPによるがん促進機構の詳細を明らかにするために、KHSRP量を低下させた細胞内のmiRNA発現を調べたところ、がんの進展を促進するmiRNA群(miR-21、miR-130b、miR-301aなど)が減少していました(図1右上)。さらにこれらのmiRNA群は、がん転移に必要なステップの一部としてよく知られている上皮間葉転換(EMT: Epithelial-to-Mesenchymal Transition)を抑制する遺伝子(BMP6、PDCD4、TIMP3など)の働きを抑え(図1右上)、がん細胞の遊走能や浸潤能を増殖や腫瘍の形成が促進されることを明らかにしました。実際に、細胞質でKHSRPが高発現している食道がん組織内では、これらのmiRNAの量が増加しEMT抑制因子の量が減少していることを確認しています(図1右下)。
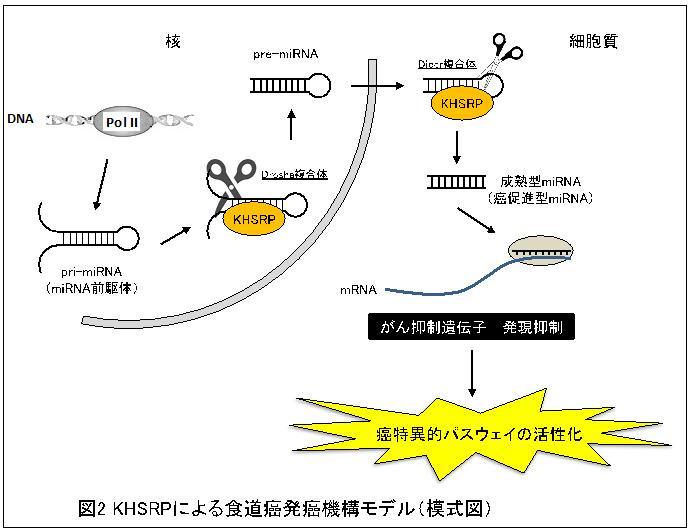
miRNAは、細胞核内でゲノムDNAから転写産物(miRNA前駆体)として作られた後、核内と細胞質内でDroshaとDicerという2つの「はさみ」に相当する酵素を中心としたタンパク質複合体によってそれぞれ切断されることで、細胞質内で成熟型のmiRNAとなり機能することが知られています(miRNAプロセシング)。KHSRPはこれらのタンパク質複合体に含まれ、miRNA前駆体と配列特異的に結合することで特定のmiRNAプロセシングを制御していると考えられており(図2)、実験により、今回明らかとなったmiR-21、miR-130b、miR-301aの前駆体に特異的に結合しその成熟miRNA量を増加させる働きを持つことを見い出しました。
今回の結果から、KHSRPは、食道がんの悪性度の診断マーカーになりうるだけでなく、食道がんの進行を制御するmiRNA群を広範囲で調節するハブ分子として有用な分子標的候補であることが示されました。KHSRPの細胞内での機能を制御することで、一度に多くのmiRNAの働きを変化させて効率的にがんの悪性形質をコントロールできる可能性があります。また、KHSRPは、子宮頸がん、肺がんなどの扁平上皮がんでも高発現していることから、KHSRPを標的とした治療法が開発できれば広範囲の扁平上皮がんに効果が期待されます。このため、今後研究グループでは、KHSRPの細胞内機能を特異的に制御する分子を特定するとともに、これらをがん特異的に抑制する治療法の開発を進めて行きます。






